 昨日(8月8日),中檢院發布了擬推薦鹽酸特拉唑嗪片、奈韋拉平片、頭孢呋辛酯片、辛伐他汀片等四個品種的參比制劑信息,供藥品生產企業參考。 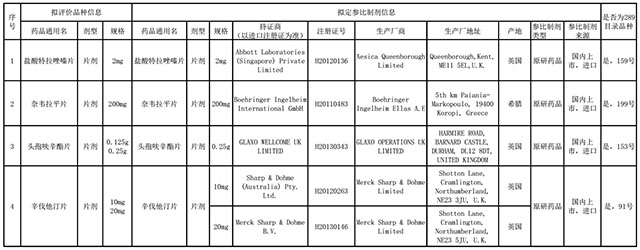 這些品種均為片劑,類型上都是原研藥品進口商品。此外,CFDA于7月29日發布了《承擔首批仿制藥質量和療效一致性評價品種復核檢驗機構名單》,并附以289個品種和承擔單位的目錄,此次的4個品種也均在289個目錄內。 E藥經理人梳理這四個品種發現:首先,這四個品種均為國內臨床應用較為成熟的品種;其次,有相關生產批件的仿制藥企數量均在10-20家;其三,這四個品種的參比制劑選擇爭議性較小;其四,這些品種在市場上有實質銷售的仿制藥企為數不多。 由此觀之,中檢院選擇公布這四個參比制劑,一方面是為了為正在進行的仿制藥一致性評價提供相應的指導意見;另一方面也是選擇爭議性較小的品種,為新規則的建立進行嘗試性的動作。 但是仿制藥企們都“被嚇了一跳”,原因是自2015年8月國務院發文要求開展仿制藥一致性評價工作以來,已經歷時近一年,此前對于參比制劑的選擇原則是:參比制劑首選國內上市的原研藥品;若原研未在國內上市或有證據證明其不符合參比制劑條件,可選用在國內上市國際公認的同種藥物;若以上兩種均不符合,可選擇在歐美日上市并被列為參比制劑的藥品。 醫藥業界對此的理解為參比制劑的選擇由企業自主決定并報CFDA備案。但是,現在游戲規則顯然正在發生巨大的變化。289個藥品的相關仿制藥企們現在需要做一個選擇:等待官方陸續公布所有需進行一致性評價的仿制藥的參比制劑公布之后,再依照細則推進?還是按照自身原來的計劃推進一致性評價工作?為此E藥經理人記者致電中檢院院長李波,但是他并未對此作出直接回應。 正向的解讀是:中檢院此次公布參比制劑,使得仿制藥一致性評價工作向前實質進行了一步,使得相關藥企有章可循。 爭議的一端是:參比制劑一年時間才公布4個,而要在2018年底完成所有仿制藥的一致性評價工作,如何達成,效率堪憂;此外,中檢院推薦的參比制劑,是由官方正式認可的金標準?還是僅僅是推薦意義?其三,行業過去一直關心的規格、BE豁免等細節問題仍然存疑。 前期投入會打水漂嗎? 仿制藥一致性評價工作在全國領域正在如火如荼地開展。據最新消息,湖北省的555個需在2018年底前完成評價工作的仿制藥批文中,首批62個批文已經進入審評階段。 盡管CFDA給出了系列的參比制劑的指導原則,但在沒有參比制劑目錄的情況下,眾多藥企仍然猶豫難定。此番中檢院公布四個參比制劑,所影響的不僅僅是四個品種所涉的藥企,也包括其它285個品種所涉的所有仿制藥企。他們的疑慮是:如果現在還不確定參比制劑,能否如期完成尚存疑問,如何能保證自身是該品種前三個獲得批準?如果其后公布的參比制劑,與現在正在進行一致性評價的參比制劑不同,那么前期所有的投入均有打水漂的危險,尤其是在目前BE試驗費用水漲船高的情況下。 某藥企總經理告訴E藥經理人:“之前CFDA公布了一系列的指導原則,讓藥企自行選擇備案,如今冷不丁推薦4個出來,如果藥企選擇的和中檢院公布的不一樣怎么辦呢?其他的參比制劑是否會出來?又是按照什么順序出來,是什么時間出來?作為藥企是應該等著金標準的公布?” 2016年5月,CFDA下發關于落實《國務院辦公廳關于開展仿制藥質量和療效一致性評價的意見》有關事項的公告。其中對參比制劑選擇的規定主要是給藥企足夠的主動權。要求藥品生產企業參照《普通口服固體制劑參比制劑選擇和確定指導原則》,并按照《仿制藥質量和療效一致性評價參比制劑備案與推薦程序》(《程序》)選擇參比制劑后向CFDA備案。 有業內人士猜測,中檢院用這么長的時間確定下來的幾個參比制劑,原則上應該是經過權衡和驗證才定下來的,此次由中檢院推薦并公開,如無意外接下來CFDA或許會進行大量的官方公告。 值得注意的是,從公布的4個品種可知,國內有原研制劑上市(進口或本地產)的品種最可能被確定為參比制劑。它們將成為國家開展仿制藥質量與療效一致性評價工作最率先開展的品種,其他暫時難以明確參比制劑的品種可能會暫且后置。 細節存疑 按照《普通口服固體制劑參比制劑選擇和確定指導原則》對仿制藥的定義,仿制藥是指與被仿制藥具有相同的活性成分、劑型、給藥途徑和治療作用的藥品,參比制劑是指用于仿制藥質量一致性評價的對照藥品,可為原研藥品或國際公認的同種藥物。因此,參比制劑原則上應該是同劑型、同規格間的藥品。在此次公布的4個參比制劑中,擬評價品種頭孢呋辛酯片的規格有兩個,分別是0.125g和0.25g,而推薦的參比制劑的規格只有0.25g。因此,有人提出質疑:頭孢呋辛酯片的0.125g如何與0.25g進行對比研究?根據早前CFDA出臺的《人體生物等效性試驗豁免指導原則》(BE豁免原則):對于處方相同,活性成分及輔料成相似比例的不同規格同種樣品,通常高劑量規格已做過BE試驗的,低劑量規格可申請免做BE試驗。這是否意味著頭孢呋辛酯片的0.125g規格可以申請BE豁免?專業人士指出,根據早前的BE豁免原則,當口服固體常釋制劑在體內的溶出快,且具有很高的溶解度的情況下,對于BCS分類1類和3類的藥物,可獲生物等效性豁免資格。而頭孢呋辛酯在BCS分類系統中屬于BCS IV類,即低溶解性、低滲透性,并不在可豁免的范圍之內。 藥企生死局開鎖 盡管業界尚存疑問,但參比制劑的出爐顯然給鹽酸特拉唑嗪片、奈韋拉平片、頭孢呋辛酯片和辛伐他汀片的仿制藥廠家指了一條明路。 據咸達數據統計,國內擁有鹽酸特拉唑嗪片批件的企業約20家,主要有賽科藥業、海南綠島以及蘇州東瑞等企業。持有奈韋拉平片文號的藥企也有10家左右,但產生銷售額的藥企僅上海迪賽諾生物醫藥和浙江華海藥業,且兩家的規則均為200mg。 頭孢呋辛酯片在國內約15家藥企持有文號,除了原研藥廠家GSK,國內仿制藥企業有蘇州中化藥品工業有限公司、深圳制藥廠,珠海聯邦和深圳致君等。其中,蘇州中化有三個文號,分別為0.125g、0.25g和0.5g,銷售額也占據優勢。 此外,對于市場競爭尤其激烈的辛伐他汀片,國內持有該品種文號的企業眾多,據悉,早先SFDA批準鹽酸特拉唑嗪片共24個批件,國內企業如浙江京新藥業等。 根據早前國家對仿制藥一致性評價工作的規定,首家品種完成一致性評價后,其他藥品生產的相同品種,原則上應在三年完成一致性評價,同品種藥品通過一致性評價生產企業達到3家以上的,在藥品政府采購方面不再選用未通過一致性評價的品種。 對于這四個藥品的生產廠家來說,參比制劑之門已經被“解鎖”,仿制藥一致性評價已經真正進入白熱化的生死競賽階段。 根據CFDA早前的公告,承擔以上4個品種的復核檢驗機構分別是浙江省食品藥品檢驗研究院、安徽省食品藥品檢驗研究院、廣東省藥品檢驗所以及四川省食品藥品檢驗檢測院。 |

