|
|
|
我國第一批鼓勵仿制藥品目錄發布 2019年最新醫藥行業相關政策匯總(表) |
作者: 來源:中商情報網 發布時間:2019-10-25 |
中商情報網訊:近日,國家衛健委發布了《第一批鼓勵仿制藥品目錄》,共33種藥品納入鼓勵仿制藥。仿制藥是指專利藥品在專利保護期結束后,不擁有該專利的藥企仿制的替代藥品。仿制藥與原研藥具有相同的活性成分、劑型、給藥途徑和治療作用。很多原研藥價格昂貴,重癥患者無力負擔,價格便宜很多的仿制藥成了他們的救命稻草。貧困患者迫切需要仿制藥,但仿制藥的供應和使用卻遇到各種各樣的障礙。仿制藥在中國藥品市場中扮演著日益重要的角色。中國醫藥工業信息中心測算得出,2016年中國仿制藥市場規模約為9167億元,受人口老齡化和醫保控費等因素的影響,中國仿制藥市場規模將持續增長。至2020年,其市場規模可能達到14116億元。
為落實國務院辦公廳《關于改革完善仿制藥供應保障及使用政策的意見》和國家衛生健康委等12部門《關于印發加快落實仿制藥供應保障及使用政策工作方案的通知》有關制定鼓勵仿制藥品目錄的部署和要求,國家衛生健康委聯合科技部、工業和信息化部、國家藥監局、國家知識產權局等部門組織專家對國內專利到期和專利即將到期尚沒有提出注冊申請、臨床供應短缺(競爭不充分)以及企業主動申報的藥品進行遴選論證,制定了《第一批鼓勵仿制藥品目錄》。具體名單如下:
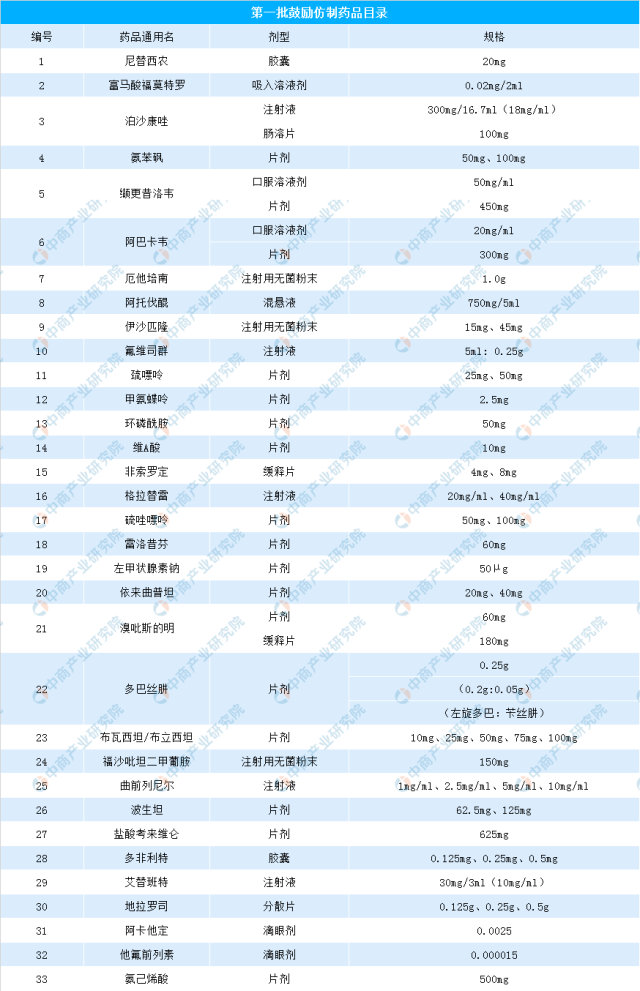 資料來源:衛健委、中商產業研究院整理
進入到2018年,中國醫藥行業步入新的發展階段,仿制藥通過國家一致性評價實現進口替代。
2018年4月,國務院《關于改革完善仿制藥供應保障及使用政策的意見》的發布,無疑將對我國仿制藥產業帶來了指導性意見。《意見》明確了鼓勵仿制藥的藥品范圍:“臨床必需、療效確切、供應短缺”的藥品。此外,鼓勵仿制重大傳染病防治和罕見病治療所需藥品、處置突發公共衛生事件所需藥品、兒童使用藥品以及專利到期前一年尚沒有提出注冊申請的藥品。
另外,12月國家衛生健康委等12部門發布的《關于印發加快落實仿制藥供應保障及使用政策工作方案的通知》,其中提出,要及時發布鼓勵仿制的藥品目錄。根據臨床用藥需求,2019年6月底前,發布第一批鼓勵仿制的藥品目錄,引導企業研發、注冊和生產。2020年起,每年年底前發布鼓勵仿制的藥品目錄。
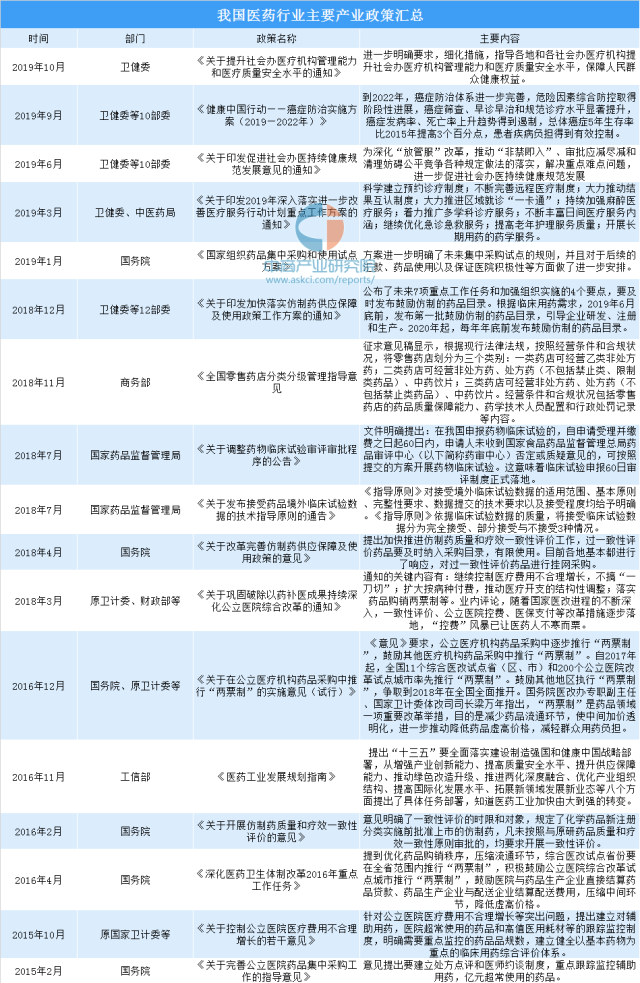 資料來源:中商產業研究院整理
|
|

